Введение
Комплекс мероприятий обеспечения безопасной эксплуатации потенциально опасных объектов включает в себя такие важнейшие элементы, как:
а) заблаговременное прогнозирование возможной обстановки на объекте и прилегающей территории при возникновении чрезвычайной ситуации;
б) оперативная оценка сложившейся при этом обстановки;
в) принятие мер экстренной защиты персонала и населения.
В комплексе мероприятий защиты производственного персонала промышленных объектов и населения от последствий пожаров и аварий на химически опасных объектах, важное место занимает заблаговременное прогнозирование возможной обстановки.
Знание сути процесса горения, его законов, механизмов и способов его прекращения, а также особенностей распространения СДЯВ при выбросе (выливе) необходимы для успешной работы каждого работника органов и подразделений по чрезвычайным ситуациям.
Описание физико-химических свойств дипропилового эфира
Дипропиловый эфир относится к классу органических веществ, называемых простые эфиры. Простыми эфирами называют производные спиртов, образованные в результате замещения водорода гидроксильной группы спирта на углеводородный остаток [1]. Эти соединения можно рассматривать и как производные воды, в молекуле которой углеводородными остатками замещены оба атома водорода:
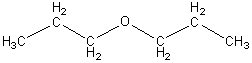
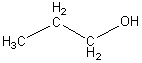
![]()
пропиловый спирт вода дипропиловый эфир
Как видно из приведенной формулы, в молекуле дипропилового эфира два углеводородных остатка (пропильные радикалы) соединены через кислород (эфирный кислород).
Для молекулы дипропилового эфира возможна внутриклассовая структурная изомерия, обусловленная различным строением углеродного скелета у изомеров. Например:

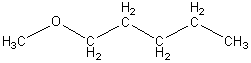
дипропиловый эфир метилпентиловый эфир
Так же имеет место ещё одна разновидность структурной изомерии, связанная с различным порядком связи структурных элементов. Например:
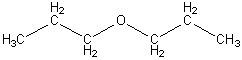
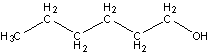
дипропиловый эфир 1-гексанол
Физико-химические свойства: бесцветная жидкость. Мол. масса 102,2; плотн. 736 кг/м3; т. плавл. – 122 °С; т. кип. 89,5°С; lgP = 6,2408 – 1397,34/(240,177 + t) при т-ре от – 43 до 89°С; коэф. диф. пара в воздухе 0,0588 см2/с (расч.); тепл. образов. – 293,4 кДж/моль; тепл. сгор. – 3760 кДж/моль (расч.); растворимость в воде 0,25 % масс.
Пожароопасные свойства: ЛВЖ. Твсп - 2°С (расч.); Тсамовоспл 189°С; НКПРП 1,22 % об. (расч.); НТПРП: - 14 °С; ВТПРП: 18°С; МВСК 9,5 % об. (расч.), при разбавлении паровоздушной смеси азотом; 12,4 % об. (рачс.) при разбавлении диоксидом углерода, 11,3 % об. (расч.) при разбавлении водяным паром; минимальная флегматизирующая концентрация диоксида углерода 39,8 % об. (расч.), азота 53,8 % об. (расч.), водяного пара 45,4 % об. (расч.); ад. т. гор. 1263 К.
Химические свойства
Главной особенностью дипропилового эфира, как и всех представителей простых эфиров, является их химическая инертность [2]. В отличие от сложных эфиров он не гидролизуется и не разлагается водой. Безводный (абсолютный) дипропиловый эфир в отличие от спиртов при обычных температурах не реагирует с металлическим натрием, т.к. в его молекулах нет активного водорода.
Расщепление дипропилового эфира происходит под действием некоторых кислот. Например, концентрированная (особенно дымящая) серная кислота поглощает пары дипропилового эфира, и при этом образуется сложный эфир серной кислоты и пропиловый спирт:
![]()
Йодистоводородная кислота также взаимодействует с дипропиловым эфиром, в результате образуется йодистый пропил и пропиловый спирт:
![]()
При нагревании металлический натрий расщепляет дипропиловый эфир с образованием пропилнатрия и пропилата натрия:
![]()
Важно иметь в виду, что обращаться с дипропиловым эфиром надо очень осторожно; он очень горюч, а пары его с воздухом образуют взрывоопасные смеси. Коме того, при длительном хранении, особенно на свету, дипропиловый эфир окисляется кислородом воздуха и в нем образуются перекисные соединения; последние от нагревания могут разлагаться с взрывом. Такие взрывы возможны при перегонке долго стоявшего эфира.

гидропероксид дипропилового эфира
Определение теоретического количества воздуха, необходимого для сгорания дипропилового эфира
Теоретическое количество воздуха определяется из уравнения материального баланса процесса горения. В случае горения дипропилового эфира уравнение реакции имеет вид:
С6Н14О + 9(О2 ∙ 3,76N2) = 6CO2 +7H2O + 33,84N2 + Q
Для индивидуальных химических веществ теоретическое количество воздуха, необходимого для их горения, рассчитывается по формуле:
Vв = ![]() , (1)
, (1)
где ![]() ; (2)
; (2)
![]() – количество молей кислорода;
– количество молей кислорода;
![]() – количество молей горючего вещества;
– количество молей горючего вещества;
4,76 – количество воздуха, кмоль (м3), в котором содержится 1 кмоль (м3) кислорода;
![]() - вес одного киломоля горючего, кг/кмоль.
- вес одного киломоля горючего, кг/кмоль.
![]() – объем одного киломоля воздуха при заданных условиях:
– объем одного киломоля воздуха при заданных условиях:
![]() =
= ![]() , (3)
, (3)
где, Т – температура, К;
![]() – нормальное давление (101325 Па);
– нормальное давление (101325 Па);
![]() – температура, равная 273 К;
– температура, равная 273 К;
P – давление, Па.
Используя формулы (1), (2), и (3) произведем расчеттеоретического количества воздуха, необходимого для горения 1 кг дипропилового эфира при температуре Т, по заданию равной 0![]() (273 К) и давлении Р, равном 750 мм рт.ст. (99991,8 Па):
(273 К) и давлении Р, равном 750 мм рт.ст. (99991,8 Па):
![]() =
= ![]() =
= ![]() = 22,7 (м3)
= 22,7 (м3)
