CO + 1/2O2 → CO2 ΔG°298 = −257 кДж, ΔS°298 = −86 Дж/K
Температура горения CO может достигать 2100 °C, она является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.) Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (например, генераторный газ), используемых, в том числе, для отопления.
Монооксид углерода реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
CO + Cl2 → COCl2
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl.
Реакцией CO с F2, кроме карбонилфторида можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42 °C, кипения +16 °C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200 °C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
(FCO)2O2 + 2KI → 2KF + I2 + 2CO2↑
Монооксид углерода реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
CO + S → COS ΔG°298 = −229 кДж, ΔS°298 = −134 Дж/K
Получены также аналогичные селеноксид COSe и теллуроксид COTe.
Восстанавливает SO2:
SO2 + 2CO → 2CO2 + S
C переходными металлами образует очень летучие, горючие и ядовитые соединения – Карбонилы, такие как Cr(CO)6, Ni(CO)4, Mn2CO10, Co2(CO)9 и др.
Монооксид углерода незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако с расплавами щелочей вступает в реакцию:
CO + KOH → HCOOK
Интересна реакция монооксида углерода с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
2K + 2CO → K+O−—C2—O−K+
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (оксид тория ThO2) по уравнению:
CO + NH3 → H2O + HCN
Условия диффузионного и кинетического горения
Горение - сложный физико-химический процесс, протекающий с выделением теплоты и света.
Диффузионное горение-горение, при котором скорость горения зависит от скорости диффузии.
Кинетическое горение - горючая смесь образуется до появления источника. Скорость горения зависит от скорости химической реакции. В зависимости от скорости выгорания горючей смеси кинетическое горение разделяют на:
Ø детонационное (скорость выгорания смеси составляет более 340 м/с);
Ø дефлаграционное( скорость выгорания смеси составляет от 40м/с до 340м/с).
Диффузионное горение СО наблюдается при выходе газа из газопровода, цистерны, баллона.
Если же газ предварительно перемещен с воздухом, а затем подожжен, то горение будет носить кинетический характер (взрыв).
Быть взрыву дефлаграционному или детонационному зависит от:
Ø природы газа ( к детонации более склонны газы: ацетилен ![]() , окись этилена
, окись этилена ![]() и т.д; менее склонны: монооксид углерода СО, пропан
и т.д; менее склонны: монооксид углерода СО, пропан ![]() ,
, ![]() ,
, ![]() );
);
Ø загроможденности окружающей среды. С увеличением загроможденности среды увеличивается турбулентность газов смеси, что приводит к увеличению скорости выгорания и возможности перехода дефлаграционного в детонационный взрыв;
Ø газокислородные смеси более склонны к детонации;
Ø от объема газовоздушной смеси.
Расчетная часть
Объём воздуха, необходимый для горения (м3/кг)
Горючее вещество имеет определенный состав. В этом случае расчет объема воздуха, необходимого для горения нужно вести по уравнению реакции горения.
![]()
![]()
56кг – (1+1∙3,76)∙24,9
1кг – x
x=2,1м3/кг
Радиус при детонационном взрыве парогазовоздушной смеси (10 тонн газа). Вычислить радиус безопасной для человека зоны
Вычислим радиус сгоревшей смеси при детонационном взрыве:
![]() ,
,
где ![]() масса газа, т
масса газа, т
![]()
Вычисляем радиус безопасной для человека зоны:
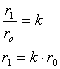 , где k=6.0 (см.табл.1)
, где k=6.0 (см.табл.1)
![]()
Зона безопасная для человека ![]() =189,6м при
=189,6м при ![]() =8 кПа,
=8 кПа, ![]() =500 кПа.
=500 кПа.
Таблица 1
|
|
Значение | ||||||||||
|
1.0 |
1.32 |
1.4 |
1.8 |
2.0 |
3.0 |
4.0 |
6.0 |
8.0 |
10.0 | ||
|
500 |
100 |
90 |
55 |
48 |
25 |
15 |
8 |
5 |
4 | ||
|
500 | |||||||||||
|
900 |
900 |
180 |
162 |
100 |
86 |
45 |
26 |
14 |
9 |
7 | |
